Material aus der Natur: ein hochelastischer Druckballon
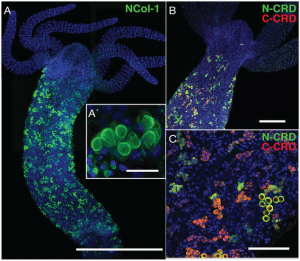
Kollagene bilden die dominierende Klasse extrazellulärer Proteine in mehrzelligen Organismen. Sie sind immer dort zahlreich vorhanden, wo eine hohe Elastizität benötigt wird. Die Kollagene von Nesseltieren – mehrzelligen Organismen, die zu den ältesten auf der Erde zählen, einschließlich Quallen und Seeanemonen – sind besonders faszinierend. Sie bauen die Wand der Nesselzelle auf, ein ballonförmiges Organell, das einem Druck von bis zu 150 Megapascal, also etwa 1500 Bar, standhalten kann. Bisher war nicht bekannt, wie Kollagene es schaffen, einen solchen hochelastischen Druckballon zu bilden.
Anhand eines sowohl experimentellen als auch theoretischen Ansatzes entdeckten nun die HITS-Forscher Prof. Frauke Gräter und Dr. Davide Mercadante der Molecular Biomechanics (MBM) Gruppe gemeinsam mit Forschern am Centre for Organismal Studies (COS) der Universität Heidelberg unter der Leitung von Dr. Suat Özbek, wie sich die kurzen Kollagenfragmente, die man auch Mini-Kollagene nennt, zu hochfunktionellen und mechanisch starken Netzwerken anordnen, die die Wand der Organelle bilden. Der Trick besteht darin, zwei unterschiedliche Arten von „klebrigen“ Bereichen an den beiden Enden des Mini-Kollagen-Proteins zu nutzen. Diese Enden enthalten besonders viele Cysteine, spezielle Bestandteile von Proteinen. Sie können dadurch die Kollagen-Moleküle vernetzen, ganz ähnlich wie das etwa im Kautschuk für die Herstellung von Reifen der Fall ist.
Obwohl bekannt war, dass die klebrigen Enden unterschiedliche Faltungen haben, war bisher unklar, ob diese verschiedenartigen Strukturen zu unterschiedlichen Funktionen führen würden. Das Forscherteam fand jetzt jedoch heraus, dass sich einer dieser Endpunkte völlig anders verhielt als der andere. Eines der Endstücke ist lediglich in der Lage, Proteinketten, sogenannte lineare Polymere, zu bilden. Der andere Endbereich hingegen kann Polymere verzweigen. Außerdem kann das „verzweigende“ Ende viel schneller polymerisieren als sein lineares Gegenstück.
Diese Unterschiede gelten als entscheidend für den Aufbau eines starken und elastischen Nesselkapsel-„Ballons“. Die Erkenntnisse können für die Entwicklung neuer Materialien nützlich sein; denn als solche können diese klebrigen Enden in jedes Molekül eingebaut werden. Die Forschungsergebnisse wurden in der April-Ausgabe von Scientific Reports veröffentlicht.
Veröffentlichung: http://www.nature.com/articles/srep25709
Wissenschaftlicher Kontakt:
Prof. Dr. Frauke Gräter
Gruppenleiterin Molecular Biomechanics am HITS
frauke.graeter@h-its.org
Tel.: 06221 – 533 – 267
Dr. Davide Mercadante
PostDoc, Universität Heidelberg & HITS
Tel.: 06221 – 533 – 254
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.