Ein unstrukturiertes Protein als Hundeleine
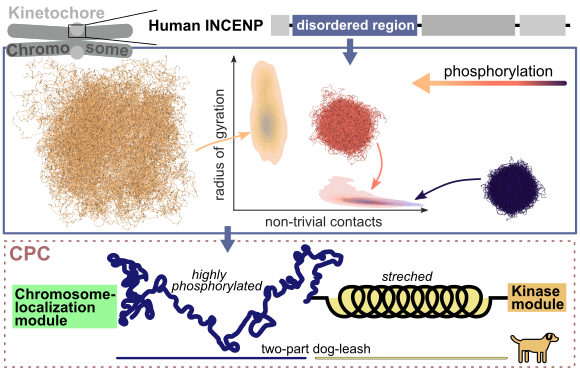
Ein Schlüsselprozess allen zellulären Lebens ist die Zellteilung, bei der das genetische Material einer Zelle verdoppelt und in zwei Tochterzellen aufgeteilt wird. Die duplizierten Chromosomen ordnen sich hierbei in der Zellmitte an und werden dort von zellulären Fäden, den Mikrotubuli, positioniert. Dieser Kontakt zwischen Chromosomen und Mikrotubuli wird von großen Proteinkomplexen, den so genannten Kinetochoren, hergestellt und sorgfältig aufeinander abgestimmt. Falsch angeheftete Chromosomen müssen zunächst abgelöst und wieder angeheftet werden, um eine gerechte Verteilung des genetischen Materials zu gewährleisten. Ein wesentlicher Akteur in diesem Korrekturmechanismus ist das innere Zentromer-protein (INCENP), das eine lange, unstrukturierte Region (IDR, intrinsically disordered region) enthält. Die Funktion dieser Domäne, die durch Phosphorylierung stark verändert werden kann, war bisher weitgehend unbekannt.
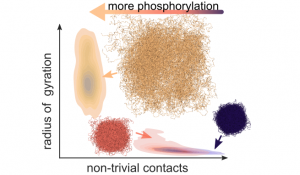
Mithilfe von Molekulardynamiksimulationen, sowohl auf atomarer als auch auf grober Ebene, untersuchten Forscher*innen der MBM-Gruppe die Auswirkungen der Phosphorylierung auf diese Domäne. Sie fanden heraus, dass die Phosphorylierung die Ausdehnung der IDR vergrößert, hauptsächlich durch die Einführung negativer Ladungen. Durch die Phosphorylierung wechselt die IDR von kollabierten Konformationen, die durch viele interne Kontakte gekennzeichnet sind, zu schwach wechselwirkenden, gestreckten Zuständen. Auf diese Weise wird durch die Phosphorylierung auch der Zusammenhalt mehrerer INCENP-Moleküle, die miteinander wechselwirken, beeinflusst. Diese Daten deuten darauf hin, dass die INCENP-IDR als phosphorylierungs-gesteuerte und längenvariable Komponente innerhalb des sogenannten „Hundeleinen-modells“ fungieren könnte, das bereits in früheren Studien vorgeschlagen wurde (Krenn et al. 2015). Hierin wird die Kinase Aurora B, die für die Ablösung falscher Chromosomen verantwortlich ist, durch eine „Hundeleine“ reguliert. Diese gibt den Abstand von Aurora B zu ihren Zielmolekülen kontrolliert vor. Somit könnte die Phosphorylierung der INCENP IDR eine Möglichkeit sein, den Aktionsradius von Aurora B zu bestimmen.
Lesen Sie den Artikel hier: Martin, Aponte-Santamaría, et al. “Phosphorylation tunes elongation propensity and cohesiveness of INCENP’s intrinsically disordered region”. J Mol Biol. 434: 167387 (2022).
Weitere Quelle: Krenn, Veronica, Musacchio, Andrea. „The aurora b kinase in chromosome bi-orientation and spindle checkpoint signaling.“ Front. Oncol. 5, 225. (2015).
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.