Eine Frage der Beweglichkeit: Multidisziplinäre Studie regt neue Strategie zur Medikamentenentwicklung an
In einer Studie zu einem Zielprotein in der Krebsforschung haben Wissenschaftler aus der akademischen und industriellen Forschung einen ungewöhnlichen Zusammenhang zwischen der Flexibilität der Bindungsstellen und der Verweildauer des Wirkstoffs am Zielprotein entdeckt. Das Forschungsprojekt ist Teil der Arbeit des „Kinetics for Drug Discovery“ (K4DD) Konsortiums und wurde durch die „Innovative Medicines Initiative“ gefördert.
Die meisten Medikamente wirken, indem sie an ein Zielprotein binden und so dessen normale Funktion behindern. Traditionell haben Wissenschaftler dafür vor allem nach Substanzen gesucht, die besonders affin sind, also fest an das Zielprotein binden: Je stärker die Bindung des Wirkstoffs, desto größer der Effekt. Doch Medikamente müssen in lebenden Organismen unter den sich dort ständig ändernden Bedingungen wirken. Deshalb setzt sich in der Wissenschaft mehr und mehr die These durch, dass bei der Medikamentenentwicklung nicht nur Affinität und Thermodynamik optimiert werden müssen. Es kommt auch auf die Verweildauer des Wirkstoffs am Zielprotein und seine Kinetik an, also auf den zeitlichen Ablauf der chemischen Prozesse.
Kinetik auf dem Prüfstand: Untersuchung eines Zielproteins aus der Krebsforschung
Ein multidisziplinäres Team aus Wissenschaftlern der K4DD Partner Merck KGaA (Darmstadt), des Heidelberger Instituts für Theoretische Studien (HITS) und des Instituto de Biologia Experimental e Tecnológica (iBET, Lissabon) hat deshalb mit modernen experimentellen und theoretischen Methoden die Faktoren untersucht, die die Verweildauer von Hemmstoffen an Zielproteinen bestimmen. Dafür nutzten sie ein in der Krebsforschung häufig getestetes Protein mit dem Namen Hitzeschockprotein 90 (HSP90). Wird HSP90 inhibiert, also gehemmt, kann der Zellzyklus unterbrochen und möglicherweise Tumoren daran gehindert werden, weiter zu wachsen. Einige der Forschungsergebnisse wurden jetzt in Nature Communications publiziert.
Überraschende Ergebnisse: höhere Beweglichkeit der Bindungsstelle führt zu längerer Verweildauer
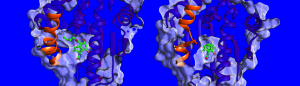
“Wir wissen zurzeit nur wenig über die Faktoren, die die Verweildauer der Wirkstoffe beeinflussen. Deshalb haben wir Thermodynamik und Kinetik gemessen, die Struktur von Komplexen aus HSP90 und Inhibitoren bestimmt, und die Dynamik der Komplexen simuliert“, berichtet Dr. Marta Amaral, eine der Erstautorinnen. Diese Strukturen, die mit Röntgenkristallographie bestimmt wurden, zeigten, dass an den Bindungsstellen zwei unterschiedliche Elemente vorhanden sein können: entweder eine Helix oder eine Schleife (siehe Bild). Komplexe mit einer Helix-Struktur an der Bindungsstelle binden den Wirkstoff länger, fanden die Wissenschaftler heraus. „Wir waren sehr erstaunt darüber, dass ein wichtiger Faktor für die lange Verweildauer die größere Beweglichkeit der Helix-Region an der Bindestelle ist, wenn ein Inhibitor daran gebunden ist“, erzählt Professorin Rebecca Wade (HITS). Dieser ungewöhnliche Bindungsmechanismus bietet neue Möglichkeiten für die Wirkstoffentwicklung: In Zukunft könnten auch weniger stabile Zielproteine in Frage kommen, die auch beweglichere Formen des Proteins bei der Bindung erzeugen – ähnlich wie bei Skischuhen mit einem Innenfutter, das sich an den Fuß anpasst. Die Ergebnisse der Studie eröffnen neue Wege, effektive Wirkstoffkandidaten mit kinetisch und thermodynamisch optimalen Eigenschaften zu finden.
Publikation:
Protein conformational flexibility modulates kinetics and thermodynamics of drug binding
Amaral M, Kokh D, Wegener A, Bomke J, Buchstaller HP, Eggenweiler HM, Matias P, Wade RC, Frech M.
Nature Communications 8, Article number: 2276 (2017) doi:10.1038/s41467-017-02258-w
Über K4DD
Das Kinetics for Drug Discovery Konsortium (K4DD) mit 20 Partnern wurde 2012 von industriellen und akademischen Forschern gemeinsam initiiert. Ziel ist es, die Analyse der Bindungskinetik von Wirkstoffen an Zielproteinen in den Entscheidungsprozess der Wirkstoffforschung zu integrieren und dadurch zur Entwicklung neuer, verbesserter Medikamente beizutragen. K4DD wurde bis Ende 2017 durch das “Innovative Medicines Initiative Joint Undertaking” (IMI JU) gefördert und erhielt Mittel aus dem 7. Rahmenprogramm der Europäischen Union (FP7/2007-2013) und von der „European Federation of Pharmaceutical Industries and Associations“ (EFPIA).
Über Merck
Merck ist ein führendes Wissenschafts- und Technologieunternehmen in den Bereichen Healthcare, Life Science und Performance Materials. Rund 50.000 Mitarbeiter arbeiten daran, Technologien weiterzuentwickeln, die das Leben bereichern – von biopharmazeutischen Therapien zur Behandlung von Krebs oder Multipler Sklerose über wegweisende Systeme für die wissenschaftliche Forschung und Produktion bis hin zu Flüssigkristallen für Smartphones oder LCD-Fernseher. 2015 erwirtschaftete Merck in 66 Ländern einen Umsatz von 12,85 Milliarden Euro. Gegründet 1668 ist Merck das älteste pharmazeutisch-chemische Unternehmen der Welt. Die Gründerfamilie ist bis heute Mehrheitseigentümerin des börsennotierten Konzerns. Merck mit Sitz in Darmstadt besitzt die globalen Rechte am Namen und der Marke Merck. Einzige Ausnahmen sind die USA und Kanada, wo das Unternehmen als EMD Serono, MilliporeSigma und EMD Performance Materials auftritt.
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.