Zum Zerreißen gespannt
Ein Riss im Sneaker, ein geplatzter Reifen – Materialermüdung ist ein alltägliches Phänomen und tritt immer zur Unzeit auf. Oftmals sorgt das lediglich für leichten Ärger, zuweilen kann es aber auch tödliche Folgen haben. Doch während das Phänomen bei synthetischen Materialien inzwischen gut erforscht ist, liegen die Gründe für Ermüdungserscheinungen im Gewebe von Säugetieren, das häufig extremer mechanischer Belastung ausgesetzt ist, noch weitgehend im Dunkeln. Ein internationales Forschungsteam unter Leitung von Wissenschaftlerinnen und Wissenschaftlern des Heidelberger Instituts für Theoretische Studien (HITS) konnte nun nachweisen, welche negativen Auswirkungen mechanische Belastung auf Kollagengewebe hat. Die Ergebnisse der Studie, die in der Fachzeitschrift Nature Communications veröffentlicht wurden, können wichtige Impulse für Materialforschung und Biomedizin liefern.
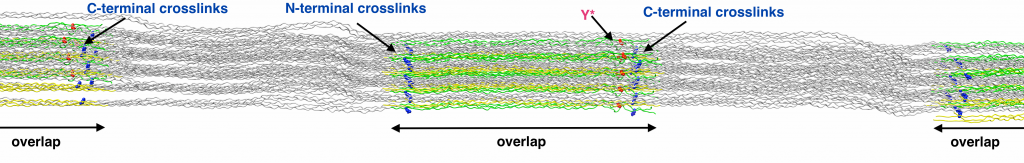
Es ist seit langem bekannt, dass synthetische Polymere unter mechanischer Belastung sogenannte Mechanoradikale bilden, die durch den Bruch chemischer Bindungen entstehen. Aber werden diese schädlichen und hochreaktiven Radikale auch in Gewebe erzeugt, das einer starken Belastung ausgesetzt ist? Wissenschaftlerinnen und Wissenschaftler der Forschungsgruppe “Molekulare Biomechanik” am HITS gingen dieser Frage am Beispiel von Kollagen nach, dem Protein, das uns im wahrsten Sinne des Wortes im Innersten zusammenhält, indem es unserem Bindegewebe in Knochen, Bändern und Haut strukturelle und mechanische Stabilität verleiht. “In dieser Rolle ist es fortwährender mechanischer Belastung ausgesetzt und somit der perfekte Kandidat für unsere Studie”, so Frauke Gräter, Forschungsleiterin am HITS. Zusammen mit Kollegen aus Homburg, Frankfurt und Seattle zeigte ihr Team in einer Reihe speziell entwickelter Experimente, dass Kollagen unter exzessiver mechanischer Belastung Radikale produziert. Diese Erkenntnis war insofern entscheidend, als Radikale dafür bekannt sind, im Körper Schäden und oxidativen Stress hervorzurufen.
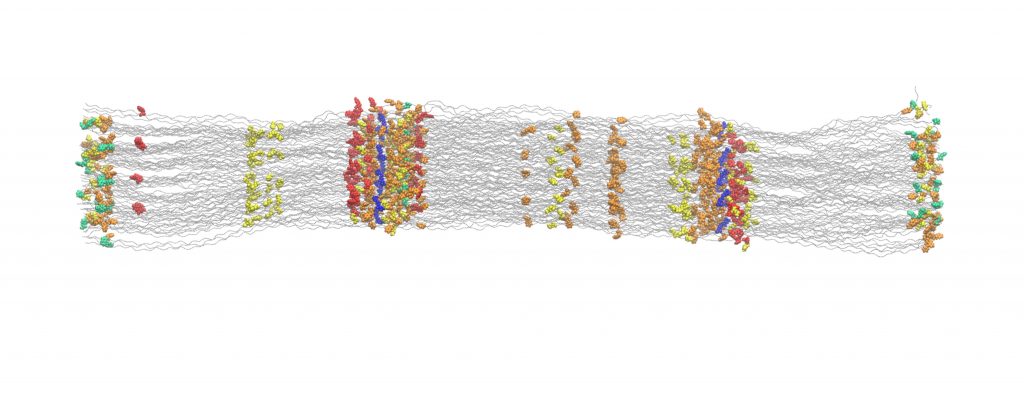
“Wir konnten die Sehne eines Rattenschwanzes gleichzeitig in die Länge ziehen und mithilfe des Elektronenspinresonanz-Verfahrens messen. Dadurch war es möglich die Radikale, die beim Ziehen entstehen, zu quantifizieren.”, erläutert Christopher Zapp, Doktorand in Gräters Team, den Versuchsaufbau. Zusätzlich durchgeführte Molekulardynamik-Simulationen einer Kollagenfibrille, bestehend aus Millionen von Atomen, bestätigten die Ergebnisse: Chemische Verbindungen brechen, wenn Kollagen gedehnt wird. Die entstehenden schädlichen Radikale werden jedoch umgehend von benachbarten aromatischen Seitenketten abgefangen. “Wir haben in Kollagen nicht nur stabile Radikale gefunden, sondern auch modifizierte Seitenketten, sogenannte DOPAs. Diese Modifikation schützt die Kollagenstruktur vor weiteren Schäden.” Die DOPA-Radikale schließlich werden in Wasserstoffperoxid umgewandelt, einem wichtigen Signalmolekül im Körper. Daraus folgt, dass Kollagen nicht nur die Kräfte überträgt, sondern auch die daraus entstehenden Konsequenzen steuern kann.
“Es war eine Herausforderung, die eigenartigen Radikalsignale in dem gedehnten Biomaterial richtig zu deuten”, fügt Reinhard Kappl von der Abteilung für Biophysik der Universität des Saarlandes und Mitautor der Studie hinzu. “Für ein vollständiges Bild bedurfte es der gebündelten Expertise verschiedener Forschungsgruppen.”
Die Resultate legen nahe, dass Kollagen sich im Körper zu einer Art „Radikalschwamm“ entwickelt hat. “Unsere Studie zeigt, dass Kollagen sich selbst vor Radikalen schützt. Wird dieser Mechanismus jedoch überdehnt, kann es zu oxidationsbedingten Schädigungen kommen, von Schmerzen bis hin zu Entzündungen”, fasst Agnieszka Obarska-Kosinska vom HITS zusammen.
Die Ergebnisse könnten nicht nur eine Erklärung dafür liefern, warum Fußballspielen zuweilen sehr schmerzhaft sein kann, sie liefern auch vielversprechende Ansätze für eine bessere Regeneration und Transplantation von Gewebe, zum Beispiel in der Sportmedizin.
Zum Paper: Nature Communications https://www.nature.com/articles/s41467-020-15567-4 (DOI https://doi.org/10.1038/s41467-020-15567-4)
Pressekontakt:
Dr. Peter Saueressig
Presse- und Öffentlichkeitsarbeit
Heidelberger Institut für Theoretische Studien (HITS)
Tel: +49 6221 533 245
Peter.Saueressig@h-its.org
https://www.h-its.org
Wissenschaftlicher Kontakt:
Prof. Dr. Frauke Gräter
Gruppenleiterin Molecular Biomechanics (MBM)
Heidelberger Institut für Theoretische Studien (HITS)
Tel: +49 6221 533 267
Frauke.Graeter@h-its.org
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.